Büyümeye Devam Ediyoruz
İngiltere’nin köklü firmalarından OMC MEDICAL’in resmi Türkiye ofisiyiz.
MDR – IVDR SÜRECİNE HAZIR MISINIZ ?
26 Mayıs 2021 itibariyle yepyeni bir dönem başladı !
CE ÜRÜN BELGELENDİRME
Teknik dosyalarınızı hazırlayıp, sisteminizi uygulanabilir hale getirerek birlikte sorunsuz bir denetim tecrübesi geçirelim
ISO 13485:2016
Medikal Kalite Yönetim Sistemi
Uluslararası Medikal Ürün Belgelendirme ve Denetim Tecrübesi
MDR / IVDR: İTHALATÇI & DİSTRİBÜTÖR
İthalatçı Firma ve Distribütörseniz, MDR & IVDR Sürecinde Karşılaşacaklarınız
Yapmanız gerekenler ve daha fazlası için
ISO 13485:2016 Kal. Yön. Sis. Kurulması
Tıbbi Cihaz üreten firmalar, tüm risk sınıfı cihazlarda deneyimli ISO 13485 Danışmanı veya bilgi birikim…
Risk Yönetimi
ISO 14971’in arka planını gözden geçirelim. Bir tıbbi cihaz üreticisi olarak yapmanız gereken ilk şey…
CE Teknik Dosya Hazırlama
MDR 2017 / 745 Ek II Tıbbi Cihaz Teknik Dosyası, söz konusu cihazın güvenliğini ve performansını göst…
İç Tetkikler, Denetçi Tetkikleri
İç denetiminiz, kapsamlı denetim deneyimine ve insan becerilerine sahip sertifikalı baş denetçi…
Tıbbi Cihaz Tek Denetim Programı
MDSAP (Tıbbi Cihaz Tek Denetim Programı), farklı düzenleme sistemleri arasında (çok) az sayıdaki…
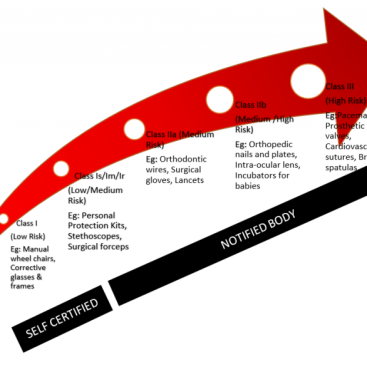
EU MDR – IVDR
Tıbbi Cihaz Sınıflandırmasının ve ilgili sınıflandırma kuralının belirlenmesi…
CE Ürün Belgelendirme
CE ürün belgelendirme Danışmanlık hizmetimizle, tıbbi cihaz üreticilerinin ürünlerini AB pazarında…
FDA Kalite Sistem Regülasyonu
ABD FDA 510(k) Danışmanlığı hizmetimiz ile, herhangi bir tıbbi cihaz…
Validasyon
Steril alan olarak belirlenen bölümlerde düzenli olarak partikül ölçümü yapılmalıdır…
Biyouyumluluk – Biyolojik Değerlendirme
Bir tıbbi cihazdan, amaçlandığı gibi kullanıldığında ve hastanın vücuduyla temas ettiğinde hastada….
Klinik Değerlendirme
Tıbbi cihaz direktifi 93/42/EEC ve tıbbi cihaz yönetmeliği 2017/745 ve hatta bir dereceye kadar…
Klinik Veri Değerlendirme
MDR Madde 2 (44) klinik değerlendirmeyi, klinik faydalar da dahil olmak üzere…
PMS & PMCF
Tıbbi cihazın sınıflandırması ne olursa olsun, Piyasa Sonrası Gözetim gerekli ve üreticilerin bir yüküm…
SSCP
Güvenlik ve Klinik Performans Özeti, sağlık çalışanlarına şunları sağlamaktır…
Gap Analizi
Sağlık kuruluşları GAP analizini hükümetlerin ve tıbbi hizmet sağlayıcıların daha iyi hizmet ve sonuçlar…
ÜTS ve EUDAMED Kayıtları
Ürün Takip Sistemi (kısa adıyla ÜTS), MDR, EUDAMED tıbbi cihaz sektörünün son dönemlerde üzerine sıklık…
Eğitim
Danışmanlık hizmeti verdiğimiz konuların birçoğu için eğitim hizmetlerimiz…
Your Regulatory Expert
Tıbbi cihaz sektöründeki 20 yıllık üretim , denetim ve Ar-ge süreçlerindeki tecrübeyle ürününüzü dünya çapındaki yasal gerekliliklere uygun olarak geliştirmenize yardımcı olacağız.
MedENvolve Consultancy







































YORUMLAR
Müşteri Memnuniyetimiz
“
“ As Growthimports, we are excited to announce that we have signed a partnership agreement with MedEVvolve Consultancy. With over 15 years experience as a lead auditor for notified bodies in the medical device industry as well as being in charge of quality assurance for various medical device manufacturers, implementation of CE marking and ISO quality systems, MedENvolve auditors brings strong experience and regulatory expertise.
”
– Emre Aykaç, Growthimports, Holland
“ I would like to thank MedENvolve consulting company for guiding us and helping my team through the CE certification process. I hope we can continue this cooperation for many years. ”
– Sertaç Karpat, HipKnee
20+Yıllık Deneyim
240+Memnun Müşteri
2000+Başarılı Proje
25+Firma Danışmanlığı
AKLINIZA TAKILAN BİR SORU MU VAR ?
Sıkça Sorulan Sorular
1) EU MDR’ye ne zaman hazırlanmaya başlamalıyım?
Medenvolve Consultancy2023-12-05T21:46:57+03:00İki yıl önce yeni yönetmeliğin yayımlanacağı duyurusu ilk yapıldığında. Yardıma ihtiyacınız olduğu için bugün 05447772038 numaralı telefondan bizi arayın.
1) When should I start preparing for the EU MDR?
Medenvolve Consultancy2023-12-07T19:02:06+03:00Two years ago when the announcement of the new regulation was first made. Call us today at 05447772038 if you need help.
2) Bu değişiklikler beni etkiler mi?
Medenvolve Consultancy2023-12-05T21:46:51+03:00
Cihazınızı Avrupa Birliği’nde (AB) MDD uyarınca pazarlıyorsanız, MDR kapsamında cihazların tarihsel tahsisinin olmadığını unutmayın. Ek olarak, cihaz sınıflandırmanız da değişmiş olabilir ve şimdi teknik dosyanın klinik değerlendirmesini ve yenilenmesini gerektirebilir.
2) Will these changes affect me?
Medenvolve Consultancy2023-12-07T19:02:37+03:00If you market your device in the European Union (EU) under the MDD, note that there is no historical allocation of devices under the MDR. In addition, your device classification may have changed and may now require clinical assessment and renewal of the technical dossier.
3) Ürünüm EU MDR’ye uymakla yükümlü mü?
Medenvolve Consultancy2023-12-05T21:46:39+03:00Yeni AB Tıbbi Cihaz Yönetmeliği, AB MDR uygulanabilirliğinin kapsamını genişletmiştir. Daha önce tıbbi cihaz olarak kabul edilmeyen bazı ürünler, artık tıbbi cihaz yönetmeliği kapsamındadır. Yeni eklenen ürünler şunları içerir:
- Göze veya göze sokulması amaçlanan kontakt lensler veya diğer maddeler.
- Dövme ürünleri ve piercingler hariç vücut parçalarının anatomisini veya fiksasyonunu değiştirmek amacıyla cerrahi olarak invaziv yollarla tamamen veya kısmen insan vücuduna sokulması amaçlanan ürünler.
- Dövme için olanlar hariç, deri altı, submukoza veya intradermal enjeksiyon veya diğer girişlerle yüz veya diğer dermal veya mukoza zarının doldurulması için kullanılması amaçlanan maddeler, madde kombinasyonları veya öğeler.
- Liposuction, lipoliz veya lipoplasti için ekipman gibi yağ dokusunu azaltmak, çıkarmak veya yok etmek için kullanılması amaçlanan ekipman.
- Tutarlı ve uyumlu olmayan kaynaklar, lazerler ve yoğun darbeli ışık ekipmanı gibi monokromatik ve geniş spektrum dahil olmak üzere insan vücudunda kullanılması amaçlanan yüksek yoğunluklu elektromanyetik radyasyon (örneğin kızıl ötesi, görünür ışık ve ultraviyole) yayan ekipman. cilt yenileme, dövme veya epilasyon veya diğer cilt tedavisi.
- Beyindeki nöronal aktiviteyi değiştirmek için kafata
3) Is my product obliged to comply with the EU MDR?
Medenvolve Consultancy2023-12-07T19:03:39+03:00The new EU Medical Device Regulation has broadened the scope of EU MDR applicability. Some products that were not previously recognized as medical devices are now covered by the medical device regulation. The newly added products include:
- Contact lenses or other substances intended to be inserted into or on the eye.
- Products intended to be inserted, in whole or in part, into the human body by surgically invasive means for the purpose of altering the anatomy or fixation of body parts, except for tattoo products and piercings.
- Substances, combinations of substances or items intended for use for filling the face or other dermal or mucous membranes by subcutaneous, submucosal or intradermal injection or other introduction, except for tattooing.
- Equipment intended for use to reduce, remove or destroy adipose tissue, such as equipment for liposuction, lipolysis or lipoplasty.
- Equipment that emits high-intensity electromagnetic radiation (e.g. infrared, visible light and ultraviolet) intended for use on the human body, including monochromatic and broad spectrum, such as coherent and incoherent sources, lasers and intense pulsed light equipment for skin resurfacing, tattooing or hair removal or other skin treatment.
- The skull to alter neuronal activity in the brain.
4) Şimdi atmam gereken ilk adım nedir?
Medenvolve Consultancy2023-12-05T21:45:32+03:00
AB’nin herhangi bir tıbbi cihaz üreticisi için büyük bir pazar olduğunu ve bu geliri kaybetmenin işiniz üzerinde olumsuz bir etkisi olacağını biliyoruz. Mevcut kalite sisteminizin ve dokümantasyonunuzun boşluk analizini yaparak başlamanızı öneririz. Aşağıdaki formu kullanarak hemen bizimle iletişime geçin. AB MDR uzmanlarından oluşan ekibimiz, sonraki adımlarınızı planlamanıza yardımcı olacaktır.
İLETİŞİME GEÇİN
Danışmanlık İsteği
[contact-form-7 id=”ef3221d” title=”Medenvolve Contact”]
(+90) 540 008 47 77
info@medenvolve.com
Pzt – Cum 09.00 – 18.00
FİRMANIZ İÇİN DENEYİMLİ BİR
Danışman Mı Arıyorsunuz?
Hemen bizimle iletişime geçin
MDR – IVDR Sürecine Hazır Mısınız ?
26 Mayıs 2021 itibarıyla Avrupa Birliği, Tıbbi Cihazlar (MDR) konusunda daha katı kurallar uygulamaktadır. 26 Mayıs 2022’den itibaren yeni düzenlemeler In Vitro Diagnostic (IVDR) Yönetmelikleri için de geçerli olacak. Distribütör veya ithalatçı olarak sizin için sonuçların ne olduğunu öğrenin.
- EUDAMED kayıt
- UDI-DI, UDI-PI
- Vigiliance System
- Compliants
- Verifications
MDR Belgelendirme
MDR danışmanlık hizmeti
IVDR Belgelendirme
IVDR Belgelendirme Hizmetleri
CE MDR Belgelendirme
CE, MDR & IVDR belgelendirme hizmetleri.
MEDENVOLVE CONSULTANCY
Hizmetlerimiz
AB MDR-IVDR
Medenvolve Consultancy2023-11-21T21:26:31+03:00
AB MDR-IVDR
Biyouyumluluk – Biyolojik Değerlendirme
Medenvolve Consultancy2023-12-07T18:22:04+03:00

Biyouyumluluk – Biyolojik Değerlendirme
CE Belgelendirme, Tıbbi Cihaz Danışmanlığı, MDR ve IVDR: Ürünlerinizi Başarıyla Piyasaya Sunun!
Medenvolve Consultancy2023-12-05T23:09:00+03:00
CE Belgelendirme, Tıbbi Cihaz Danışmanlığı, MDR ve IVDR: Ürünlerinizi Başarıyla Piyasaya Sunun!
FDA Kalite Sistem Regülasyonu
Medenvolve Consultancy2023-12-05T16:47:22+03:00

FDA Kalite Sistem Regülasyonu
İç Tetkikçiler, Tedarikçi Denetimleri
Medenvolve Consultancy2023-12-08T18:40:41+03:00

İç Tetkikçiler, Tedarikçi Denetimleri
Klinik Değerlendirme
Medenvolve Consultancy2023-12-08T18:41:51+03:00

Klinik Değerlendirme
Klinik Veri Değerlendirme
Medenvolve Consultancy2023-11-21T20:15:44+03:00

Klinik Veri Değerlendirme
MDR/ IVDR : İthalatçı & Distribütör
Medenvolve Consultancy2023-11-21T22:00:24+03:00

MDR/ IVDR : İthalatçı & Distribütör
Medikal Cihaz Dizayn, Proses ve Yazılım Validasyon Danışmanlığı
Medenvolve Consultancy2023-11-21T20:44:05+03:00

Medikal Cihaz Dizayn, Proses ve Yazılım Validasyon Danışmanlığı
PMCF
Medenvolve Consultancy2023-11-21T21:48:00+03:00

PMCF
PMS
Medenvolve Consultancy2023-11-21T20:10:55+03:00

PMS
Sağlık hizmetlerinde GAP analizi
Medenvolve Consultancy2023-12-08T18:43:20+03:00

Sağlık hizmetlerinde GAP analizi
SSCP
Medenvolve Consultancy2023-12-08T18:44:38+03:00

SSCP
Tıbbi Cihaz Tek Denetim Programı (MDSAP)
Medenvolve Consultancy2023-11-21T21:29:34+03:00

Tıbbi Cihaz Tek Denetim Programı (MDSAP)
Tıbbi Cihazlar için CE Teknik Dosya (MDR)
Medenvolve Consultancy2023-12-05T23:10:45+03:00

Tıbbi Cihazlar için CE Teknik Dosya (MDR)
Tıbbi Cihazlar İçin ISO 13485 Danışmanlığı
Medenvolve Consultancy2023-12-08T18:48:42+03:00

Tıbbi Cihazlar İçin ISO 13485 Danışmanlığı
Tıbbi Cihazlar İçin ISO 14971 Risk Yönetimi
Medenvolve Consultancy2023-12-08T18:47:13+03:00

Tıbbi Cihazlar İçin ISO 14971 Risk Yönetimi
ÜTS ve Eudamed Kayıtları
Medenvolve Consultancy2023-12-05T23:12:20+03:00

ÜTS ve Eudamed Kayıtları
“Happiness is the meaning and the purpose of life, the whole aim and end of human existence.”
– Aristotle
(Greek Philosopher)
YARARLI BİLGİLER
Sektörden Ve Bizden Haberler

IVDR Transition Process
Medenvolve Consultancy2023-12-08T20:07:43+03:00
Regulation (EU) No 2022/112 of the EUROPEAN COMMISSION of 25 January 2022 amends Regulation (EU) 2017/746 on the…
08 Ara 2023Medenvolve ConsultancyUncategorized0 Yorumlar
Read more +

Validity of ISO 13485 QMS certificates after Brexit
Medenvolve Consultancy2023-12-22T11:06:56+03:00
A quality management system (QMS) based on the ISO 13485 standard is an internationally recognised model that a…
08 Ara 2023Medenvolve ConsultancyNews0 Yorumlar
Read more +